摘 要 為了探討蘇北地區人工養殖銀鯽(Carassius auratus gibelio)“鰓出血病”的致病病原,取呈現“鰓出血病”典型癥狀的銀鯽鰓組織與肝、脾、腎等內臟器官,制作成組織漿并通過離心分離上清液后均分為4份,分別采用孔徑為0.22µm的濾菌膜對上清液過濾除菌、添加雙抗殺菌、加熱滅菌和不做任何處理等4種方法制備上清液樣品,并以健康銀鯽組織漿上清液和滅菌生理鹽水做對照組。以平均體重為(280.0±13.0)g的銀鯽作為試驗成魚組,體重為(87.0±9.0)g的銀鯽作為試驗幼魚組。經胸鰭基部對每尾成魚注射0.3mL,對每尾幼魚注射0.2mL的上清液后,放回水族箱中繼續飼養觀察14d,比較了各試驗組銀鯽的發病狀況和死亡率。結果表明,對健康銀鯽注射過濾除菌、藥物殺菌、加熱滅菌以及未做處理的患病銀鯽組織漿上清液后,4個試驗組成魚的成活率分別為20.0%、0、80.0%和0,而注射正常銀鯽組織漿上清液的成活率為90.0%,注射滅菌生理鹽水的試驗成魚的成活率為100.0%。接種過濾除菌、藥物殺菌、加熱滅菌以及未做處理的組織漿上清液后,4個試驗組幼魚的成活率則分別為50.0%、30.0%、90.0%和30.0%,而注射正常銀鯽組織漿上清液和滅菌生理鹽水的試驗幼魚的成活率均為100.0%。利用人工感染后發病銀鯽組織漿制備的上清液樣品,再次接種銀鯽的成魚和幼魚,結果是注射過濾除菌、藥物殺菌、加熱滅菌以及未做處理的組織漿上清液后,4個試驗組試驗成魚的成活率分別為10.0%、10.0%、0和80.0%,而注射正常銀鯽組織漿上清液的成活率為80.0%,注射滅菌生理鹽水的試驗成魚成活率為100.0%。接種過濾除菌、藥物殺菌、加熱滅菌以及未做處理的患病銀鯽組織漿上清液后,4個試驗組試驗幼魚的成活率則分別為40.0%、20.0%、50.0%和20.0%,而注射正常銀鯽組織漿上清液的銀鯽幼魚成活率為90.0%,注射滅菌生理鹽水的試驗銀鯽幼魚成活率為100.0%。這種結果預示著蘇北地區人工養殖銀鯽“鰓出血病”的致病病原可能是某種致病病毒。
關鍵詞 銀鯽;鰓出血病;病原
近年來,江蘇省鹽城地區和大豐等地人工養殖銀鯽(Carassius auratus gibelio),從2009年5月開始,陸續出現以鰓出血為典型病癥(圖1)的暴發性疾病,導致人工養殖銀鯽的大面積暴發性死亡,已經對當地的銀鯽養殖業者造成了重大經濟損失。
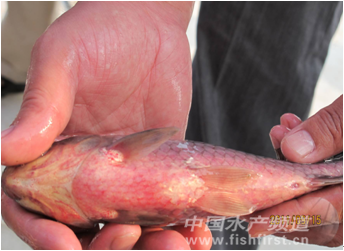
圖1 患“鰓出血病”的銀鯽
由于我國過去對銀鯽病害防治研究基礎比較差,對引起暴發性疾病的原因尚不清楚。廣大養殖業者面對突然暴發的銀鯽疾病缺乏適宜的防治對策,一些針對水產養殖動物疾病的常規防治措施,如采用生石灰和氯制劑消毒及內服抗生素等,均難以有效控制銀鯽“鰓出血病”的蔓延。
探明銀鯽暴發性鰓出血病的病原,是做到對癥施治、有效地控制該病的前提。本研究從發病養殖池塘收集具有典型病癥的銀鯽,將患鰓出血病銀鯽鰓組織與內臟組織取出來,勻漿后離心并收集其上清液。通過利用不同的方法處理上清液后制備成帶有不同種類病原的組織漿上清液,將其作為感染源注射接種健康銀鯽后,根據供試銀鯽發生疾病和死亡的狀況,推測出人工養殖銀鯽“鰓出血病”的病原可能是某種病毒。現將試驗結果報道如下。
1 材料與方法
1.1 試驗健康銀鯽來源及試驗設計
從江蘇省鹽城地區射陽黃沙港養殖區采集的身體無損傷、色澤正常、健康活潑的銀鯽作為本研究試驗魚。依據銀鯽體重將試驗魚分為2個不同的規格,即將體重為(280.0±13.0)g的銀鯽作為試驗成魚組,體重為(87.0±9.0)g的銀鯽作為試驗幼魚組。將供試銀鯽分別飼養于塑料水族箱中,預備飼養7 d后,從各組銀鯽中選擇無任何不良癥狀的銀鯽作為本次試驗用魚。每個規格的試驗魚設5個組。在每個盛有1.5 M3的塑料水族箱中放養10尾銀鯽。在預備飼養期間,在各水族箱中控制水溫變化在22~26℃之間,用充氣泵24 h 連續充氣,早、晚各投喂鹽城裕達飼料有限公司生產的鯽全價飼料各1次。
1.2 患病銀鯽來源與感染源制備
具有暴發性疾病典型癥狀的患病銀鯽從鹽城地區射陽縣黃沙港水產養殖區某養殖池塘中獲得。將患病銀鯽解剖后取出鰓組織和肝、脾、腎臟等內部器官,利用電動攪肉機將這些鰓組織和內部器官進行組織勻漿后離心并收集上清液,將收集的上清液均分為4份盛裝在三角燒瓶中。將第1份上清液在濾菌器中經孔徑為0.22µm的濾菌膜過濾,除去其中細菌后作為濾菌上清液樣品;在第2份上清液中加入青霉素和鏈霉素(Difco),使這2種抗生素在上清液中的濃度分別達到100.0µg/g,殺菌處理30 min后作為殺菌上清液樣品;將盛裝第3份上清液的三角燒瓶置于100℃水浴鍋中,保持1 h以殺滅其中的細菌和病毒后,作為加熱殺菌上清液樣品。用移液器分別在第1份、第2份和第3份上清液樣品中,分別取100.0µL上清液接種在BHIA(Difco)平皿中,在25℃培養箱中培養48 h,證實3種上清液樣品中沒有存活細菌后,作為不同處理的試驗組注射上清液樣品,如果有菌落出現則將該樣品棄之不用。對第4份組織漿液不作任何處理,作為有細菌和病毒試驗組注射上清液樣品。另外,選擇10尾無任何癥狀50.0g左右的銀鯽,依上述方法制備組織漿和上清液,不做任何處理即作為第5份未經處理的正常組織漿液上清液。制作好的上清液樣品均保存在4℃冰箱中,備用。
1.3 注射上清液接種
采用經過胸鰭基部注射的方法接種上述各種組織漿上清液,對試驗成魚組每尾供試魚注射0.3mL,而對試驗幼魚組每尾供試魚注射0.2mL。將注射濾菌上清液樣品的供試魚作為試驗1組;注射藥物殺菌上清樣品作為試驗2組;注射熱滅活上清樣品的供試魚作為試驗3組,注射未經處理的患病魚組織上清液樣品的試驗魚作為第4組,注射未經處理的正常魚組織上清液樣品的試驗魚作為第5組,將注射0.7%的滅菌生理鹽水的試驗魚作為對照組。注射結束后仍然放回水族箱中繼續飼養。
1.4 用感染后患病銀鯽制備組織漿上清液后人工再接種
從人工注射患病銀鯽組織漿上清液后,發生“鰓出血病”典型癥狀的銀鯽中選取數尾魚,按照1.2項中所述方法制備患病與正常魚組織漿上清液后,按照1.3所述方法再次注射接種供試銀鯽。以觀察供試銀鯽的疾病發生與死亡狀況。
1.5 飼養觀察
對經過注射接種后各規格的試驗組銀鯽按照體重的2.0%投喂飼料,每天早晚各1次。自注射結束后開始計算,連續飼養觀察14 d,記錄供試銀鯽疾病發生狀態以及死亡發生的時間。
2 結果
2.1 注射病魚組織上清液后銀鯽發病與死亡狀況
采用不同方式處理后的病魚組織上清液注射不同規格銀鯽后,供試銀鯽疾病發生狀態和死亡時間狀況見表1。從表1可以看出,經過接種經不同方法處理的患病與正常銀鯽組織漿上清液后,成魚發病和死亡率均比幼魚高。接種過濾除菌組試驗成魚在14d的觀察期內,僅有20.0%的存活率,藥物處理組試驗成魚100.0%死亡,加熱處理組試驗成魚只有80.0%存活率,未做處理對照組試驗成魚全部死亡,注射正常組織上清液的試驗成魚有90.0%存活,而注射滅菌生理鹽水的對照成魚100.0%存活。
表1 注射各種處理的患病銀鯽組織漿上清液后不同規格銀鯽成活率
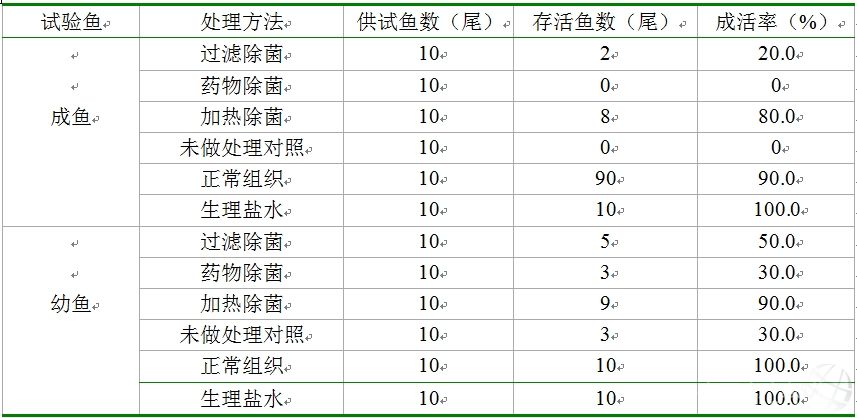
試驗魚 處理方法 供試魚數(尾) 存活魚數(尾) 成活率(%)
成魚 過濾除菌 10 2 20.0
藥物除菌 10 0 0
加熱除菌 10 8 80.0
未做處理對照 10 0 0
正常組織 10 90 90.0
生理鹽水 10 10 100.0
幼魚 過濾除菌 10 5 50.0
藥物除菌 10 3 30.0
加熱除菌 10 9 90.0
未做處理對照 10 3 30.0
正常組織 10 10 100.0
生理鹽水 10 10 100.0
在相同的飼養方式和條件下,供試銀鯽幼魚死亡率則比較低。經過接種不同方法處理的患病與正常銀鯽組織漿上清液后,接種過濾除菌試驗幼魚在14d的觀察期內,供試魚有50.0%存活,藥物處理組試驗幼魚組30.0%存活;加熱處理組試驗幼魚有90.0%存活,未做處理對照組試驗幼魚30.0%存活,注射正常組織上清液的試驗幼魚100.0%存活,而注射滅菌生理鹽水的對照幼魚也是100.0%存活。
2.2 注射人工致病銀鯽組織上清液后銀鯽發病與死亡狀況
從人工致病銀鯽中收集鰓組織和肝、脾、腎臟組織,采用不同方式處理后制備成病魚組織上清液注射不同規格銀鯽后,供試銀鯽疾病發生狀態和死亡時間狀況見表2。從表2可以看出,接種過濾除菌試驗成魚在14d的觀察期內,供試成魚有10.0%存活;藥物處理組試驗成魚組10.0%存活;加熱處理組試驗成魚有100.0%存活;未做處理對照組試驗成魚沒有魚存活;注射正常組織上清液的試驗成魚80.0%存活;而注射滅菌生理鹽水的對照成魚100.0%存活。
表2 注射各種處理的人工致病銀鯽組織漿上清液后不同規格銀鯽成活率
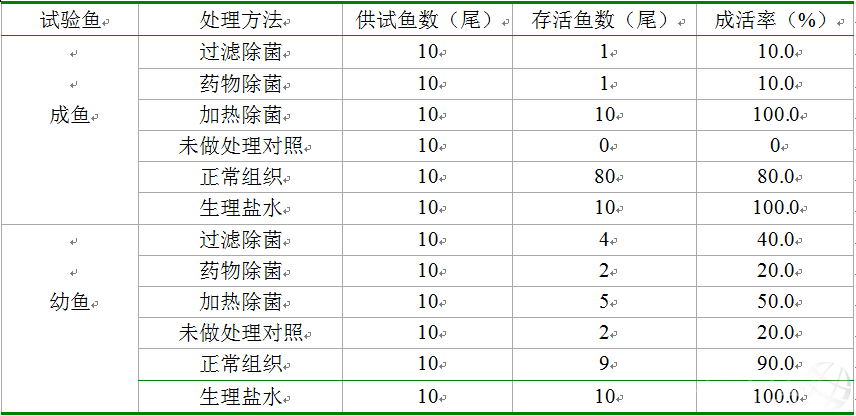
試驗魚 處理方法 供試魚數(尾) 存活魚數(尾) 成活率(%)
成魚 過濾除菌 10 1 10.0
藥物除菌 10 1 10.0
加熱除菌 10 10 100.0
未做處理對照 10 0 0
正常組織 10 80 80.0
生理鹽水 10 10 100.0
幼魚 過濾除菌 10 4 40.0
藥物除菌 10 2 20.0
加熱除菌 10 5 50.0
未做處理對照 10 2 20.0
正常組織 10 9 90.0
生理鹽水 10 10 100.0
在相同的飼養方式和條件下,供試銀鯽的幼魚死亡率比較低。接種過濾除菌試驗成魚在14d的觀察期內,供試幼魚有40.0%存活;藥物處理組試驗成魚組20.0%存活;加熱處理組試驗幼魚有50.0%存活,未做處理對照組試驗幼魚20.0%存活;注射正常組織上清液的試驗成魚90.0%存活,而注射滅菌生理鹽水的對照成魚100.0%存活。
3 討論
在養殖現場對蘇北地區人工養殖銀鯽出現大批死亡的魚體,進行解剖學檢查時,可以觀察到2種比較明顯的癥狀。有一種癥狀是鰓絲腫脹,養殖業者將具有這種癥狀的病魚稱作“大紅鰓”(圖2)。這種所謂的“大紅鰓”病,是從2008年上半年開始在蘇北地區零

圖2 患“大紅鰓”的銀鯽
星出現,發病時間從5月初開始,瀕死魚“黑頭”較多。除感染危害銀鯽外,還可感染草魚及團頭魴。患“大紅鰓”病魚的鰓絲呈現鮮紅色,當患病魚體離水數分鐘后鰓絲即轉為暗紅色,一般有出現“花鰓”的現象,鏡檢通常發現鰓上有指環蟲,解剖發現內部器官出現不同程度的糜爛,有比較多的淡黃色透明腹水。患病池塘大多用過刺激性較強的殺蟲藥物,發生“大紅鰓”病后銀鯽的死亡量較大,但是,通過采用微生態制劑等改善水質環境、二氧化氯等消毒劑進行水體消毒,同時選擇對致病菌敏感的抗生素類藥物投喂,可以有效地緩解這種疾病的蔓延速度。
另一種癥狀主要是呈現“鰓出血”的癥狀,這種疾病自2009年開始最先在射陽周邊的養殖場出現。發病時間從4月初即開始,主要感染100.0g以上的銀鯽,表現為鰓部嚴重充血,嚴重時出現鰓部向外噴血的現象(圖3),將具有典型癥狀的瀕死魚提離水面時,鰓部

圖3 接種患病銀鯽組織漿上清液后,患病魚鰓部噴血導致水族箱中水色變紅
(左下方水族箱)
即開始大量出血,血液會順著鰓絲流出,在下頜等體表處分布點狀出血點,解剖見肝臟出血,脾臟、腎臟腫大,嚴重時魚鰾分布大量出血點。對于出現“鰓出血病”癥狀的池塘,通過采用微生態制劑等改善水質環境、二氧化氯等消毒劑進行水體消毒,同時選擇對致病菌敏感的抗生素類藥物投喂,不能有效地緩解這種疾病的蔓延速度。因此,目前對于這種疾病尚無有效控制措施。
在本研究中,我們采用對患病銀鯽組織上清液進行濾菌膜過濾除菌、添加雙抗藥物處理殺菌、加熱處理殺菌以及不做任何處理等方法制備病魚組織漿上清液樣品,與注射正常組織上清液和滅菌生理鹽水的試驗于比較,初步闡明了養殖銀鯽“鰓出血病”的病原可能是某種病毒。這是因為將患病銀鯽組織上清液進行濾菌膜過濾和添加雙抗藥物處理,均可以達到除去或者殺滅組織漿上清液中細菌而保留病毒的目的,而對健康銀鯽接種這些組織上清液后能導致試驗與出現“鰓出血”的典型癥狀。通過接種經過加熱處理和正常組織上清液的試驗魚存活率均比較高,可能預示著組織漿上清液中的銀鯽組織,對供試健康銀鯽不會導致出現疾病癥狀。而注射滅菌生理鹽水的對照魚均未出現異常狀況,說明飼養條件和注射操作對試驗魚造成的應激性刺激不至于導致供試魚發生“鰓出血病”。
我們這個研究結果雖然未能證明養殖銀鯽“鰓出血病”究竟是由什么種類的病毒引起的,但是,已經初步提示這種病的病原有可能是某種病毒,從而為這種疾病的預防和治療提示了方向。
陳昌福1) 孟憲東2) 郭 慶2) 陳亮波2) 金 玲2) (1)華中農業大學水產學院,武漢 430070; (2)鹽城裕達飼料有限公司,江蘇鹽城 224341 中國水產頻道獨家稿件,轉載請注明出處! |