日志
碳酸鈣
|
3 碳酸鈣
3.1 緒言
碳酸鈣(CaCO3),主要以礦物方解石的形式出現,無處不在。碳酸鈣可以純粹的無機或可生物介導沉淀而形成。存在于土壤,巖石和沉積物中。它在許多生物礦化組織中也起著重要的作用,是海洋沉積物中最重要的生物成分。富含碳酸鹽(>30% CaCO3)的沉積物構成大陸斜坡和深海大約55%的礦床(Schneider et al., 2000)。碳酸鈣也是風化速度最快的的礦物質(Scheffer and Schachtschabel, 1992)。由于快速風化和碳酸鹽系統的緩沖能力,少量的 CaCO3 可以主宰水生系統的地球化學行為。天然水體與碳酸鹽礦物的反應對大氣和海洋化學也具有重要的控制作用(Morse,1990)。
多種二價金屬離子表現出與CaCO3的吸附和共沉淀的親和力。由于二價金屬離子無處不在,CaCO3中二價金屬離子的數量反映了形成時的環境條件。摻入海洋生物殼體中的二價金屬離子特別的引人注目,因為它可以幫助重建過去的環境條件(Boyle, 1981; Boyle, 1988; Lea and Boyle, 1989; Lea and Boyle, 1990; Lea and Spero, 1992; Lea et al., 1995; Mashiotta et al., 1997; Russel et al., 1994; Spero et al., 1997)。
CaCO3體系不僅是受到關注的重要自然系統。碳酸鈣在廣泛的工業應用中,也起著重要的作用。只提一個:CaCO3垢的形成在氣體、油、水的輸送過程中可導致重大障礙和生產損失。CaCO3與人類活動造成的有毒元素如鎘(Cd)和放射性核素之間的相互作用可能提供新的污染修復工具。
由于碳酸鈣的重要性和豐富度,在過去的30年中碳酸鈣系統和二價金屬離子的相互作用已經進行了大量的研究。近年來,由于新的表面敏感的儀器技術的可用性,如原子力顯微鏡(AFM),透射電子顯微鏡(TEM),掃描隧道顯微鏡(STM)和低能電子衍射(LEED),我們對CaCO3和水溶液的相互作用的理解已取得顯著進展。本章的目的是提供CaCO3系統和二價金屬離子的吸附的一般描述。
3.2 溶液平衡
水溶液中CaCO3的化學平衡可以被描述為水合二氧化碳,或碳酸,經歷解離(電離)的過程 (Pilson, 1998),
CO2(gas) ←KH→ CO2(aq) (3.1)
CO2(gas) + H2O ←K0→ H2CO3 (3.2)
H2CO3 ←K1→ HCO3- + H+ (3.3)
HCO3- ←K2→ CO32- + H+ (3.4)
以及鈣離子的離子對形成和水解(Sawada, 1998):
Ca2+ + HCO3- ←Kc1→ CaHCO3+ (3.5)
Ca2+ + CO32- ←Kc2→ CaCO30 (3.6)
Ca2+ + OH- ←Kc3→CaOH+ (3.7)
一般來說,碳酸鈣的沉淀可以寫成:
CaCO3 (solid) ←Kcc→ Ca2+ + CO32- (3.8)
此外,在水系統中,必須考慮水(H2O)的離解:
H2O ←Kw→ H+ + OH- (3.9)
下一節將更詳細地描述了碳酸鈣平衡所涉及的不同步驟。在這個討論中,[ ]對應的是濃度,而{ }表示活度。平衡常數(K)的負對數用縮寫pK表示。
水的解離(公式3.9):可以從方程3.9看出,水解離成氫(H+)和羥基(OH -)離子。應該提到的是,游離H+離子是不存在的。氫以水合的形式H3O+存在。然而,為了簡便起見,一般用H+的方式來表示H3O+。25°C離解反應的pK(公式3.10)是 13.999(Buttler, 1982)。
{H+}×{OH-} = KW{H2O} (3.10)
亨利定律(方程1):二氧化碳(CO2)氣體溶于水的程度有分壓所決定,溶解的二氧化碳與其他溶質的相互作用(記為(aq))。CO2濃度通常是由亨利定律表示(Buttler, 1982):
[CO2] = KH pCO2 (3.11)
亨利定律常數KH25°C時大約是為10-1.5,水溶液含量以摩爾每升表示,CO2的分壓(pCO2)以巴表示 (Buttler, 1982)。
水合作用(方程3.2):當二氧化碳溶解于酸性水時大部分分子仍然是游離的、未水合的CO2(寫為CO2(aq))。一些分子與水結合(方程3.2)。與電離反應比較,這種反應是很慢的。然而,在平衡時{H2CO3}只有{CO2(aq)}的10-3,對酸堿平衡沒有特別的意義,由于CO2(aq)和H2CO3是不帶電的(Buttler, 1982)。傳統上,CO2(aq)和H2CO3兩種物質合并處理都當成一個物質(如CO2(aq))。平衡計算的常數K0(公式3.2)不大重要,因為CO2(aq)的濃度是直接與p CO2成正比。值得注意的是,在堿性溶液中,下列反應也變得非常重要:
CO2(aq) + OH- ←→ HCO3- (3.12)
電離(方程3.3和3.4):水合二氧化碳的電離出H+,HCO3-和CO32-。在25°C和1.013巴時下列系統中的pK值是K1為6.681和K2為 10.329(Plummer and Busenberg, 1982):
{H+}{HCO3-} = K1{CO2(aq)}{H2O} (3.13)
{H+}{CO32-} = K2{HCO3-} (3.14)
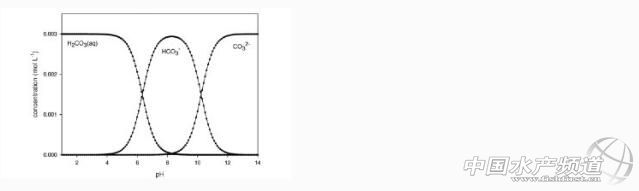
水合碳酸鹽各種成分的pH函數如圖3.1所示。
圖3.1:主要的碳酸種類的形態取決于pH值(總濃度為0.003摩爾/升,T=20°C,封閉系統,離子強度I = 0)
如果在前面描述的系統添加鈣,系統中將出現以下額外的水溶性物質(方程3.5,3.6,3.7):Ca2+、CaHCO3+、CaCO30和CaOH+。25°C時下列反應的平衡常數(pK)是: KC1,11.434; KC2,3.22(Plummer and Busenberg, 1982),KC3為-12.697(NIST 46.3):
{CaHCO3+} = KC1{Ca2+}{HCO3-} (3.15)
{CaCO30} = KC2{Ca2+}{CO32-} (3.16)
{CaOH+} = KC3{Ca2+}{OH-} (3.17)
在這一點上,根據方程3.8,沒有單一的一個平衡常數可以給出CaCO3的形成。原因是 CaCO3有不同的多晶型存在,下節將討論CaCO3的多晶型。
3.3 CaCO3 的多晶型及其特性
碳酸鈣可以三種無水結晶晶型的形式出現:球霰石、文石和方解石。其溶解度積(K)在表3.1中給出。已知三水合狀態的碳酸鈣存在(Elfil and Roques, 2001)。無定形碳酸鈣(ACC),一水碳酸鈣(MCC)(礦物名稱單水碳酸巖)和六水合碳酸鈣(HCC)(礦物名稱ikaite)。表3.1給出溶解度積(K)。
表3.1:25°C時一般形態的不同碳酸鈣晶型的溶解度常數
晶型 pK at 25°C log K (T in K and t in °C) Ref.
ACC 6.28 10 < t < 55°C 6.1987 + 0.00053369 t + 0.0001096 t2 a*
HCC 6.59 0 < t < 25°C 0.1598 - 2011.1/T b*
MCC 7.15 15 < t < 50°C 7.050 + 0.000159 t2 c*
球霰石 7.913±0.020 0 < t < 90°C -172.1295 - 0.077993 T + 3074.688/T + 71.595 log T d*
文石 8.336±0.020 0 < t < 90°C -171.9773 - 0.07793 T + 2903.293/T + 71.595 log T d*
方解石 8.480±0.020 0 < t < 90°C -171.9065–0.077993 T+2839.319/T + 71.595 log T d*
(a*) (Brečević and Nielsen, 1989), (b*) (Bischoff et al., 1993), c* (Kralj and Brecevic, 1995), (d*) (Plummer and Busenberg, 1982).
3.3.1 A非晶碳酸鈣
非晶碳酸鈣是溶解度最高的形態。非晶碳酸鈣常常以直徑小于1μ的球形存在,這是一個不穩定階段,將在幾分鐘內轉入結晶階段:在較低的溫度(10-30°C)下是球霰石和方解石的混合物;在較高的溫度(60-80°C)下是文石;在中間溫度(40-50°C)時觀察到形成上述所有的三個相(Ogino et al., 1987)。在一般情況下,非晶碳酸鈣是實驗室進行的實驗中碳酸鈣沉淀的中間階段。最近,不同的作者表明,非晶碳酸鈣在碳酸鈣的生物礦化過程中起著重要作用(e.g. Aizenberg et al., 1997; Beniash et al., 1997)。在生物系統中,非晶碳酸鈣可以作為其他碳酸鹽相的前體(如在無機系統中),或是防止穩定非晶碳酸鈣有機大分子的形態轉化。
3.3.2 六水碳酸鈣
六水碳酸鈣(CaCO3•6H2O) 1916年就已經提到,是實驗室實驗中許多碳酸鈣形態的一種(Johnston et al., 1916)。Pauly(1963)首先報道了自然出現的六水碳酸鈣。根據礦物的發現地點命名為ikaite,位于格陵蘭島IKA峽灣的底部(Pauly,1963)。后來也在其他地方也發現ikaite。所有的自然現象似乎是缺氧的,水的溫度為3°C或更低。對詳細的綜述感興趣的讀者可參考Bischoff et al. (1993)的報告。Pauly (1963)提出, ikaite 巖柱在IKA峽灣的形成是峽灣底部淡水滲流導致的。Buchardt等人(1997)通過測量滲水的化學成分證實了這一理論。他們發現,高pH值和富含磷酸鹽的冷泉水在來自水下泉的低溫條件下與海水混合。
六水碳酸鈣具有單斜晶系結構(空間基團為C2/c或Cc),鈣與六個水分子的結合比與碳酸根離子的結合更緊密,密度為1.8 g/cm3(Bischoff et al., 1993)。據Johnston (1916)記載的方法制備的晶體,描述為成型良好的棱形晶體,平均尺寸約為30×30×15μm(Bischoff et al., 1993)。磷酸鹽的存在抑制了無水碳酸鈣晶體的生長而使六水碳酸鈣得以生長(Dickens and Brown, 1970)。因此,大多數六水碳酸鈣合成的實驗程序通常包括抑制無水晶體形成的物質,例如,多聚磷酸鈉鎂或離子(Dickens and Brown, 1970)。在溫度大約為0°C時六水碳酸鈣是穩定的,但在更高的溫度下分解迅速,形成無水相(球霰石或方解石)和水,導致密度增加(Mackenzie, 1923)。已被發現在25°C和5 MPa壓力下六水碳酸鈣是相對穩定的(Marland, 1975)(圖3.2)。與其他 CaCO3 的晶型相反,六水碳酸鈣的溶解度隨溫度升高而提高(圖3.3)(Bischoff et al., . 1993)。
圖3.3:表示溫度與日ikaite、球霰石、文石和方解石log K的關系。在0°C ikaite比其他相更易溶。這是溶解度隨溫度增加而增加唯一的相(引自Bischoff et al., 1993)。
3.3.3 一水碳酸鈣
一水碳酸鈣(CaCO3•H2O),與六水碳酸鈣一樣,是在實驗室的實驗中首次觀察到。許多工人合成過一水碳酸鈣,通常作為嘗試沉淀白云石產生的副產品(綜述見Taylor, 1975)。自然環境中的一水碳酸鈣已在1959首次報道(Fleischer, 1969),他發現土耳其斯坦伊塞克湖的鈣質結殼完全由一水碳酸鈣所組成。這一階段的礦物名稱為單水碳酸巖,因為該碳酸巖含有一個水分子(參考文獻:Fleischer, 1969)。單水碳酸巖也在瑞士弗蘭肯、德國的小洞穴的石筍中發現(Fischbeck and Müller, 1971),以及作為對虎鯊(Calcocerdo Cuvier)耳石成分(Carlström, 1963)。在Taylor(1975)報道,在澳大利亞東南部兩個小湖泊中發現單水碳酸巖(Taylor, 1975)。
一水碳酸鈣晶體多為球形,直徑近100μm。一水碳酸鈣晶體系統為六角形(三角)(水晶類32)。報道中一水碳酸鈣的密度為 2.38g/cm3。
3.3.4 球霰石
在球霰石、文石和方解石這三種無水碳酸鈣的多晶型中,球霰石的可溶性最高。根據Friedman 和 Schulz (1995),Linck (1903)以發現者,H. Vater,來命名這種礦物后,盡管這一聲明不能在引用參考驗證。這個名字的確回到H. Vater,但Meigen可能是第一個在1911年使用球霰石這個名字的,“Vater第三改性碳酸鈣”(Gibson et al., 1925),Vater (1897)在他的論文中描述了一種球形的碳酸鈣。在后來的工作,Vater也描述了沉淀物中有一些透鏡狀聚集體和六角板的形狀。后來Johnston et al. (1916)確認這些聚集體為一個單獨的形態,命名為μ碳酸鈣。據Wolf et al. (2000)報道,Vater 也用μCaCO3這個詞,但這論點不能被文獻引用者證實(Vater, 1897; Vater, 1899)。歷史上球霰石的命名在參考上是混亂和不連貫的,μ-CaCO3 貫穿廣泛的文獻。
Heide (1924)認為球霰石是一種改性的CaCO3,不同于文石和方解石,穩定性不如兩者。他指出,球霰石的德拜-謝樂圖(X射線衍射)與方解石和文石不同,以此證明第三種改性的碳酸鈣晶型的存在。Gibson et al. (1925) 指出,這種改性Vater描述為“第三改性碳酸鈣”表明與方解石的X射線衍射圖案相同,而按Heide (1924) 描述的方法制備的球形碳酸鈣晶體與Johnston et al. (1916)描述的 μ-CaCO3顯示相同的X射線衍射圖案。然而,球霰石這個名字一直在文獻中存在。
在地球表面的條件下球霰石在水溶液中不穩定,將在很短的時間內轉化為方解石或文石(取決于溫度)(Ogino et al., 1987)。這就是為什么球霰石在自然環境中很少見的原因之一。第4章和第5章詳細描述和球霰石的形成和轉化。
球霰石屬于六方晶系(晶體類6/m 2/m 2/m)(kamhi,1963),密度為2.54 g/cm3。
3.3.5 文石和方解石
相比于其他碳酸鈣多晶型,文石和方解石的文獻是巨大的。因此,我放棄了這些晶型的詳細的描述,因為有興趣的讀者可以在其他地方輕易的找到合適的信息。下面列出方解石和文石的基本礦物學數據。
文石是以“Molina de Aragón”的地方命名(瓜達拉哈拉,西班牙),在阿拉貢25公里外。文石屬于正交晶系(晶體類2/m2/m2/m),密度為2.94 g/cm3。文石的顯著特性是它的穩定性隨溫度的升高而下降的(在400°C文石自發地轉變成方解石),但不隨壓力的增加而改變。方解石的名稱來源于拉丁語的生石灰(石灰)。密度為2.71g/cm3 ,屬于三角對稱系統(晶體類3 2/m)。
3.4 二價金屬離子在碳酸鈣中的摻入
在晶體的沉析過程中,建立了一個三維的周期性結構,外圍的離子可以納入置換固體的主要離子(如Sr2+取代CaCO3中的Ca2+)。根據感興趣的元素的純系可以區分兩種不同的固溶體的特性。有些礦物存在著一個完美的端元相之間的相容性。一個很好的例子是在礦物橄欖石中([Mg, Fe]2Si2O4)的完美的混合性的二元相鎂橄欖石(Mg2Si2O4)和鐵橄欖石(Fe2Si2O4)。相比之下,菱鎘礦(CdCO3)和CaCO3在Cd2+/Ca2+離子比較寬
全部作者的其他最新日志
- • 池塘里的那些事兒(4)
- • 池塘里的那些事兒(3)
- • 池塘里的那些事兒(2)
- • 池塘里的那些事兒(1)